记住,阿尔茨海默病不是简单的“老糊涂”,而是不可逆的神经退行性疾病,每一个阶段的信号都值得被重视。
阿尔茨海默病(AD)是一种起病隐匿、进展缓慢的神经退行性疾病,其病程从无症状的病理改变期,到最终多因并发症离世,整体可分为7个核心阶段,症状从轻微的记忆减退逐步发展为完全丧失生活自理能力,不同阶段的病程时长存在个体差异,且目前尚无根治方法,早发现、早干预是延缓病情进展的关键。
阶段0:临床前无症状期(病理改变已发生)
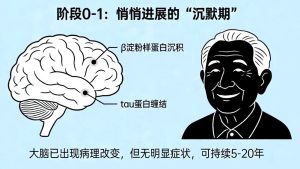
此阶段无任何明显症状,大脑已出现β淀粉样蛋白沉积、tau蛋白缠结等特征性病理改变,部分人群可能存在轻微的脑代谢异常。病程可持续5-20年,通过脑脊液检测、PET-CT、基因检测等手段可发现异常,是目前早筛干预的重要窗口期。
阶段1:极轻微的认知衰退
无明显临床症状,本人和家属均无法察觉异常,仅在专业的神经心理测试中,可能发现极轻微的记忆或注意力波动,日常工作、生活完全不受影响,易被误认为是正常的年龄相关记忆减退。
阶段2:轻度认知障碍期(AD早期核心信号)

出现轻度、间歇性的记忆减退,是最易被发现的发病阶段,核心表现为忘记近期的小事(如刚说过的话、随手放的物品)、记不住新认识的人、偶尔出现语言表达卡顿,但其认知能力仍能支撑独立生活,社交、工作基本不受影响,部分人会自我感觉“记性大不如前”。
阶段3:中度认知障碍期(轻度痴呆)
记忆减退从间歇性变为持续性,且影响日常行为,核心表现为忘记重要事件(如生日、约会)、无法独立完成复杂家务(如做饭、理财)、出现定向障碍(偶尔迷路)、情绪开始变得焦虑、易怒或淡漠,家属能明显察觉认知异常,此阶段需开始针对性的药物和非药物干预,延缓病情进展。
阶段4:中重度认知障碍期(中度痴呆)

认知功能进一步衰退,生活自理能力开始丧失,核心表现为无法独立处理财务、忘记个人经历(如家庭住址、亲人姓名)、定向障碍加重(频繁迷路,甚至不认识熟悉的环境)、出现性格改变(如多疑、偏执、抑郁),无法独立出门,需要家属协助完成穿衣、洗漱等部分日常事务。
阶段5:重度认知障碍期(重度痴呆)
完全丧失生活自理能力,认知功能严重受损,核心表现为无法辨认亲人、甚至不认识自己,语言表达能力大幅下降(仅能说简单的词语或无法说话),无法独立进食、穿衣、如厕,出现大小便失禁,情绪可能变得淡漠或出现无目的的行为(如反复踱步、翻东西),需要家属24小时贴身照料。
阶段6:终末期(濒死阶段)
此阶段患者的认知功能几乎完全丧失,全身多系统功能衰退,核心表现为卧床不起、无法自主进食(需鼻饲)、失去语言和肢体活动能力,对外界刺激无明显反应,易引发各种严重并发症,如肺部感染、尿路感染、压疮、营养不良、器官衰竭等,这也是阿尔茨海默病患者离世的主要原因,此阶段以对症护理、提高生存质量为主。
阿尔茨海默病的病程进展受年龄、基因、干预时机、护理水平等多种因素影响,从早期症状出现到终末期,一般可持续8-10年,部分患者因护理得当,病程可延长至15年以上。而临床前无症状期的早筛,能让高风险人群通过生活方式干预(如规律运动、认知训练、健康饮食)、药物干预等方式,最大程度延缓症状出现的时间。

对于普通人而言,尤其是家中有老年人的群体,无需因偶尔的记忆减退过度焦虑,但当出现持续性的近事遗忘、定向障碍、行为异常等信号时,需及时到神经内科或记忆门诊就诊,通过专业的认知评估、影像学检查和生物标志物检测明确诊断,避免错过最佳干预时机。而对患者的照料,不仅需要药物治疗,更需要家属的耐心、陪伴和科学的护理,这也是提高患者不同病程阶段生存质量的核心。早筛是守护记忆健康的第一道防线,精准的检测技术能让我们更早发现风险、把握干预时机,潘道生物始终专注于精准医疗领域的技术研发与应用,依托专业的检测体系,为大众提供阿尔茨海默病早期筛查服务,用科技的力量助力每一个家庭守住珍贵的记忆,让陪伴的时光更长久。

